avanços da ciência em relação à prevenção e ao tratamento da aids, que permitiram melhorar a qualidade de vida das
pessoas e criar mecanismos para evitar novas infecções, ainda são desconhecidos e inacessíveis a uma parcela da
população. A avaliação é da médica infectologista da Fiocruz Valdiléa Veloso dos Santos. "Por mais que a ciê
ncia avance nas tecnologias, nós não vamos dar uma resposta adequada à epidemia se nós não enfrentarmos a violência estrutural", observou.
Durante o 11º Seminário LGBT do Congresso Nacional, a pesquisadora destacou que pesquisas recentes mostram que com a prescrição de medicamentos
para uma pessoa que tem alto risco de se contaminar por HIV é possível prevenir, reduzir significativamente a chance dessa pessoa se infectar, tanto antes quanto após o contato com o vírus.
"No contexto de uma
relação sorodiscordante (um dos parceiros é soropositivo), se a gente tratar precocemente o risco contágio pode ser reduzido em 96%. Isso é muita coisa, equivale praticamente ao resultado de uma vacina", disse. Valdiléa dos Santos citou
ainda outros estudos mostrando que 30% das pessoas infectadas não adquiriram o HIV dos seus parceiros, adquiriam de uma relação fora daquela parceria.
Ela ainda comentou a baixa adesão ao uso da camisinha como forma de
prevenção. "A gente vem dizendo ao longo dessas três décadas: use camisinha, use camisinha. Mas sabe que a adesão não é boa", completou, acrescentando que os dados revelam 50% de eficiência do dispositivo. "Claro, porque para funcionar tem que usar sempre. Cada um pode se perguntar: quem usa sempre?"
Representante do Ministério da Saúde, Ivo Brito também comentou o que chamou de revolução no campo da prevenção. "Nós estamos deixando de olhar apenas para os métodos tradicionais e trazendo alguns outros métodos para a discussão", disse ele, alertando para uma possível medicalização do assunto.
Ele sustentou que o governo está reafirmando a convicção de que é fundamental a profilaxia pós-exposição como medida obrigatória para combater novos contágios. "O mesmo vale para a profilaxia pré-exposição, que deve ser direcionada a grupos de risco", completou.
Antiretrovirais
Uns dos medicamentos antirretrovirais é comercialmente chamado de Truvada. A droga foi aprovada em 2012 pela FDA, agência sanitária americana, como a primeira pílula para ajudar a prevenir o contágio do HIV. Ela é indicada para pessoas saudá
veis que possuem vida sexualmente ativa em grupos de risco ou que mantêm relações sexuais com parceiros soropositivos. Segundo estudos realizados em 2010, o medicamento fabricado pelo laboratório Gilead Sciences reduz entre 44% e 73% o risco de
infecção pela aids.
A diretora adjunta do Departamento de Vigilância, Prevenção e Controle das DST,
Aids e Hepatites Virais do Ministério da Saúde, Adele Benzaken, disse no seminário que o ministério está focando a ampliação da testagem em transexuais, profissionais do sexo, gays e usuários de drogas. "Queremos incluir 68 mil pacientes que estão com sistema imunológico em níveis críticos no
tratamento antirretroviral", disse ela, lembrando a primeira importação do comprimido que reúne três remédios do coquetel anti-aids em um só.
DEBATEDORES APONTAM AFROUXAMENTO EM AÇÕES E PROGRAMAS DE COMBATE À AIDS
Debatedores do 11º Seminário LGBT do Congresso Nacional apontaram um afrouxamento no conjunto de ações e programas de governo voltados para combater o avanço da aids no País. Segundo eles, paira uma falsa sensação de que a epidemia está controlada, sobretudo por conta de remédios mais eficazes, com menos efeitos colaterais, e que melhoram a
qualidade de vida do portador do vírus HIV que já desenvolveu a Síndrome da Imunodeficiência Adquirida (em inglês, aids).
"Hoje em dia, quando tratadas, as pessoas convivem com o HIV e têm uma vida praticamente normal", destacou o deputado Jean Wyllis (Psol-RJ), um dos organizadores do seminário que teve como tema "Aids: Formas de saber. Formas de adoecer". Para ele, essa nova realidade mudou o discurso público em torno da aids. "Isso trouxe um efeito muito ruim que foi o afrouxamento da prevenção e a invisibilidade da doença no discurso público de saúde", acrescentou.
Para Wyllis, a falta de campanhas informativas e de prevenção da aids tem feito a doença avançar sobre grupos de homens jovens gays (15 a 25 anos), mulheres, pessoas pobres e moradores do interior do País. "Alguma coisa não está funcionando na política de prevenção à aids. E a gente precisa fazer esse diagnóstico. O que é que mudou?", questionou.
Médico e coordenador do Programa de Mestrado em DST/aids e Hepatites Virais da UnioRio, Fernando Ferry, afirmou que a sensação de que a epidemia está controlada favorece novos contágios. "Hoje enquanto você está fazendo o tratamento, você tira da mídia toda a questão da morte, incluindo a de pessoas famosas, porque as famílias não permitem que se divulgue", disse ele, ressaltando que a desinformação é um grande problema, sobretudo entre os jovens.
Segundo Ferry, no Hospital Universitário Gaffrée e Guinle, no Rio, onde ele atua, os pacientes infectados são geralmente pobres, jovens, negros, homossexuais e mulheres. "Como a maioria toma conhecimento do HIV na emergência, muitos já apresentam a doença em
estágio avançado", completou ele, destacando também o aumento de novos casos de outras doenças sexualmente transmissíveis (DSTs), como hepatite, sífilis e HPV.
Para a jornalista Roseli Tardelli, a acomodação em relação à epidemia de aids não envolve só governos mas também a mídia e a comunidade científica. "Parece que a ciência já respondeu a uma pergunta importante. Hoje nós temos aí uma série de remédios que permitem conviver com HIV/aids", disse Tardelli, que atua como diretora-executiva da Agência de Notícias da Aids.
"Mortes e as tragédias que foram a vivência da aids como nós vivemos, como a minha família viveu, como a mãe do Cazuza viveu, e tantas outras viveram, não estão mais sendo retratadas", completou ela, que criou a agência após perder um irmão para a doença.
Desconhecimento
O deputado Amauri Teixeira (PT-BA), que preside a Comissão de Seguridade Social e Família da Câmara, afirmou que a atual geração desconhece a dimensão da doença. "Nós somos de uma geração que conhece a aids em sua fase mais cruel. Perdemos amigos, ídolos e pessoas que admirávamos", afirmou. Para ele, a informação é a base de toda e qualquer política de saúde e deve ser usada como instrumento de prevenção e de esclarecimento.
"É preciso esclarecer para prevenir e para deixar claro que o portador não é nenhum bicho de sete cabeças."
Para a médica infectologista da Fiocruz, Valdiléa Veloso dos Santos, os avanços da ciência em termos de prevenção e tratamento devem estar acessíveis a todos. "Temos que encontrar uma forma de comunicar o que existe hoje para pessoas de diferentes níveis de escolaridade e de inserção na sociedade e com diferentes necessidades. Porque não podemos ampliar as desigualdades", disse.
No ano de 2012, foram notificados 39.185 casos de aids no Brasil. A taxa de detecção nacional foi de 20,2 casos para cada 100.000 habitantes. As maiores taxas de detecção ocorreram no Rio Grande do Sul (41,4), em Santa Catarina (33,5), no Amazonas (29,2) e no Rio de Janeiro (28,7).
DEPUTADOS DEFENDEM POLÍTICAS DE PREVENÇÃO AO PRECONCEITO
O coordenador geral LGBT da Secretaria Especial de Direitos Humanos da Presidência da República, Gustavo Bernardes, comemorou, durante o 1º Seminário LGBT do Congresso Nacional, a publicação da Lei 12.984/14, que determina pena de prisão, de um a quatro anos, e multa para quem discrimina pessoas com HIV. Bernardes aproveitou para cobrar também a aprovação do projeto de lei que criminaliza a homofobia no País.
"Jovens gays são mais vulneráveis à epidemia de aids. Isso porque ele se expõe mais e são mais suscetíveis à violência", disse. "Que essa casa não se omita, que criminalize à homofobia", completou.
A deputada Manoela D'Ávila (PCdoB-RS) destacou a sanção da nova lei que prevê punição para condutas como recusar inscrição em escola; negar
emprego ou trabalho; demitir; segregar no ambiente escolar ou de trabalho; divulgar a condição de pessoa com HIV com intuito de ofender; e recusar tratamento de saúde.
No entanto, segundo ela, a lei sancionada trata de punição à discriminação, ou seja, pune quem já é preconceituoso. "Mas e o que estamos fazendo para educar as pessoas e
evitar o preconceito?", questionou a deputada, comentando o recente veto da presidente Dilma Rousseff ao programa do Ministério da Educação, conhecido como 'kit gay', que pretendia o combate à homofobia nas escolas.
Plano Nacional de Educação
Manoela criticou ainda a exclusão do texto do Plano Nacional de Educação (PNE - PL 8035/10) de dispositivo que tratava da questão de gênero."Vamos levar permanentemente preconceituosos à cadeia ou vamos evitar que as pessoas se tornem preconceituosas", completou.
O texto aprovado pela Câmara no dia 3 fala apenas em erradicação de todas as formas de discriminação, mas a parlamentar defende que sejam incluído como destaque ao texto aprovado nesta terça-feira trecho que diz: "São diretrizes do PNE a superação das desigualdades educacionais, com ênfase na promoção da igualdade racial, regional, de gênero e de orientação sexual".
A deputada Érika Kokay (PT-DF) defendeu a importância da educação para desconstruir as lógicas excludentes. "Não se pode negar a afetividade e a sexualidade humanas. Não existe cidadania dentro do armário", afirmou. A deputada ainda criticou o projeto em tramitação na Câmara que cria o Estatuto da Família, definindo-a como com a união entre homens e mulheres apenas.
AIDS AVANÇA SOBRE JOVENS HOMOSSEXUAIS, POBRES E MULHERES
"A aids se juvenizou. E desses jovens infectados pelo HIV, a população de homens jovens gays, voltou a ser o grupo vitima preferencial", disse Wyllis, que participa das frentes parlamentares em Defesa dos Direitos Humanos, de Enfrentamento às DST/HIV/Aids e pela Cidadania LGBT.
Em audiência na Comissão de Fiscalização e Controle da Câmara dos Deputados, o ministro da Saúde, Arthur Chioro, reconheceu que o aumento do número de casos de aids entre homens que têm relações sexuais com outros homens tem se mostrado preocupante nos últimos 10 anos. "São as áreas que a gente observa tendência de crescimento", apontou Chioro.
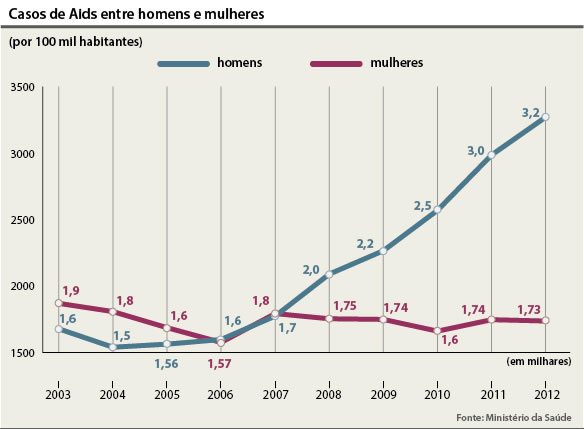
Jean Wyllis ainda condenou, no entanto, o discurso que coloca a aids como castigo aos homossexuais e ressaltou o aumento de casos entres mulheres. "Temos a feminilização da doença. No início da epidemia eram 30 homens infectados para cada mulher. Hoje essa proporção é de 1 para 1." O deputado criticou a atuação do Ministério Saúde, diante das evidências desse perfil epidemiológico do País.
Tendência diferente
Representando o Ministério da Saúde, Ivo Brito discordou da visão que aponta como tendências atuais o contágio de jovens, de mulheres e da população do interior do País. Para ele, essa é uma tendência que já marcou os anos 90 e a primeira década do século 21. "Nossos dados mostram outra tendência", disse Brito.
Com relação ao aumento proporcional da infecção de mulheres, ele disse que, isolando-se homens e mulheres na estatística, verifica-se um aumento maior da epidemia entre homens jovens. Brito acrescentou ainda que a epidemia cresce também entre segmentos com maior escolaridade. "Ou seja, diferente do que ocorria na década de 90."
O desafio, segundo ele, é pensar em políticas públicas focadas nos grupos de risco sem
criar um efeito bumerangue, ou seja, incentivando ainda mais a marginalização e a discriminação desses grupos sociais, como a comunidade LGBT.
Desigualdade
Para o presidente Associação Brasileira Interdisciplinar de Aids (Abia), Richard Parker, a determinante fundamental da epidemia de aids é a desigualdade. "É onde a desigualdade é mais forte, onde um eixo de desigualdade, do tipo pobreza, cruza com outro, desigualdade de gênero, que você tem um maior impacto da epidemia. A sinergia entre essas forças de desigualdade cria uma maior vulnerabilidade", sustentou.
Ex-diretor adjunto do Departamento de DST, Aids e Hepatites Virais do Ministério da Saúde, Eduardo Barbosa, hoje afirma que, além de terem perdido força, as campanhas muitas vezes não chegam aos públicos-alvo. Para ele, à medida que a questão da vulnerabilidade foi acentuada no discurso, o risco maior de infecção de algumas comunidades foi sendo esquecido. "Hoje se fala em vulnerabilidade como se todos fossem igualmente vulneráveis, homens, mulheres. Mas a epidemia está pegando é gay", disse Barbosa, que coordena o Centro de Referência e Defesa da Diversidade de São Paulo.
Apesar de considerar importante reconhecer que a aids não tem cara, cor, classe social, ou orientação sexual, Parker concorda que a Aids não é uma epidemia igualitária ou democrática. "Nem todas as pessoas enfrentam os mesmo riscos frente à epidemia de aids. Os grupos populacionais não existem na mesma situação", disse. Para Parker, a atual fase da fase da epidemia, denominada por ele como "estigma e discriminação" é talvez a mais difícil de ser vencida.
Reportagem – Murilo Souza
Edição – Rachel Librelon
Fonte - Agência Câmara Notícias
Leia mais: AIDS: muitos muitos desconhecem medicamentos que dão qualidade de vida e evitam novas infecções - PFARMA http://pfarma.com.br/noticia-setor-farmaceutico/saude/1636-aids-muitos-muitos-desconhecem-medicamentos-que-dao-qualidade-de-vida-e-evitam-novas-infeccoes.html#ixzz34i7xXlpG





 16:42
16:42
 TATI DALLA
TATI DALLA